2021-04-07
近日,最好的十大体育外围平台王泽方教授联合团队在重要先天免疫蛋白家族鸟苷酸结合蛋白(GBP)的结构与功能研究中取得重要突破,在国际著名学术期刊美国科学院院刊《Proceedings of the National Academy of Sciences of the United States of America》(PNAS) 上发表题为“Structural Basis for GTP-induced Dimerization and Antiviral Function of Guanylate-binding Proteins”的研究论文。论文中报道了GBP5在激活前以及激活后两种状态下的三维空间结构,揭示了GBP家族发生激活变构的分子机制。

GBP家族成员是干扰素诱导表达的一类重要的先天免疫蛋白,广泛参与宿主对病毒(HIV-1病毒、流感病毒、丙型肝炎病毒和卡波西氏肉瘤病毒等),细菌(结核分枝杆菌、团菌以及福式志贺菌)以及原生动物(弓形虫)的免疫反应。此外,GBP家族蛋白还参与炎症信号通路的调控,是免疫系统的“枢纽”。因此,揭示GBP家族蛋白被信号激活的分子机制,对深入认知免疫系统的工作机理以及开发新型抗感染治疗手段显得尤为重要。
GBP蛋白究竟如何被激活?学术界过去十余年间对该科学问题存在巨大分歧。作为dynamin超家族中的成员,GBP蛋白的头部是一个球形的GTP酶结构域,而尾部则是一个杆状的螺旋结构域,而它在GTP的作用下会产生较大构象变化,从而引发后续一系列免疫反应进程。在2006年,Ghosh等人曾在《自然》杂志提出了一个“敞开式”激活模型。在该模型中,两个GBP蛋白分子通过头部结合在一起,而各自的尾部则伸向相反的方向,宛如人体“跨步”时的姿态。在过去15年间,该模型在领域里一直处于统治地位。
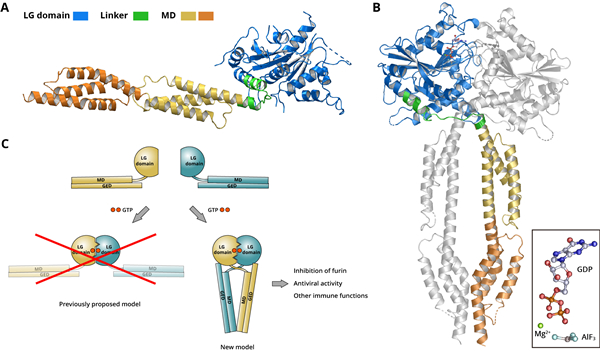
(A)GBP5激活前的三维空间结构;(B)GBP5激活后的三维空间结构;(C)GBP蛋白的激活变构机制
为了探究GBP家族成员被激活的精确分子机制,崔闻等研究人员历时五年时间,率先在国际上解析了GBP5近全长分子在激活前、后的三维空间结构。研究显示,当GBP5蛋白结合GTP后会发生水解反应,同时两个GBP5分子会发生“头对头”的结合。但让研究人员出乎意料的是,头部的“碰撞”会进一步诱导两个GBP5蛋白质分子的尾部分别发生较大角度偏转,从而相互靠近、交叉并在末端形成另一个“脚并脚”的结合界面。该实验观测到的GBP激活过程完全不同于以前学界所了解的“敞开式”激活模型,而完全呈现出一个“闭合式”的激活模型。更形象的说,该激活状态完全不像前文所述的人体的“跨步”态,而更接近于人体的“站立”态。在此基础上,研究小组继续开展了抗HIV 病毒实验、溶液状态的小角散射等多学科交叉实验;一系列实验都证实该激活模型对GBP家族的多个成员完全适用。
此项研究工作首次描绘了精确的GBP蛋白激活变构的分子机制,彻底纠正了领域内十余年间对GBP激活机制的认识上的误区,为进一步深入理解GBP蛋白家族在先天免疫中发挥的功能提供了重要的理论基础。
最好的十大体育外围平台博士生崔闻为论文的第一作者,十大滚球外围平台王泽方教授为论文的共同通讯作者,十大滚球外围平台为本论文的第一通讯单位。本项工作由十大滚球外围平台、上海科技大学、重庆医科大学、德国乌尔姆大学、中山大学、耶鲁大学和南京大学等多个单位合作完成。晶体衍射数据收集得到上海同步辐射光源和国家蛋白质(上海)设施的帮助。本项研究得到了科技部国家重点基础研究发展计划,国家自然科学基金以及天津市杰出青年科学基金等项目的支持。
原文链接:https://www.pnas.org/content/118/15/e2022269118